- Автор Jason Gerald [email protected].
- Public 2024-02-01 14:15.
- Последнее изменение 2025-06-01 06:07.
Вы когда-нибудь оставляли бутылку с водой на палящем солнце на несколько часов и слышали легкий "шипящий" звук, когда открывали ее? Это связано с принципом, называемым давлением пара. В химии давление пара - это давление, оказываемое стенками закрытого контейнера, когда химическое вещество в нем испаряется (превращается в газ). Чтобы найти давление пара при заданной температуре, используйте уравнение Клаузиуса-Клапейрона: ln (P1 / P2) = (ΔHСтим/ R) ((1 / T2) - (1 / T1)).
Шаг
Метод 1 из 3: Использование уравнения Клаузиуса-Клапейрона
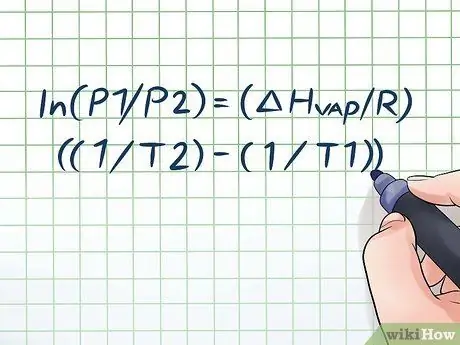
Шаг 1. Запишите уравнение Клаузиуса-Клапейрона
Формула, используемая для расчета давления пара с изменением давления пара с течением времени, называется уравнением Клаузиуса-Клапейрона (названного в честь физиков Рудольфа Клаузиуса и Бенуа Поля мили Клапейрона). Это в основном формула, которая понадобится вам для решения большинства типов задач. Вопросы о давлении пара часто встречаются на уроках физики и химии. Формула такая: ln (P1 / P2) = (ΔHСтим/ R) ((1 / T2) - (1 / T1)). В этой формуле переменные представляют:
-
ЧАССтим:
Энтальпия испарения жидкости. Эту энтальпию обычно можно найти в таблице в конце учебника химии.
-
Р:
Действительная / универсальная газовая постоянная, или 8,314 Дж / (К × моль).
-
Q1:
Температура, при которой известно давление пара (или начальная температура).
-
Т2:
Температура, при которой давление пара неизвестно / требуется определить (или конечная температура).
-
P1 и P2:
Давление паров при температурах Т1 и Т2 соответственно.

Шаг 2. Введите известные вам переменные
Уравнение Клаузиуса-Клапейрона выглядит сложным, потому что в нем много разных переменных, но на самом деле это не так уж сложно, если у вас есть правильная информация. В большинстве основных задач, связанных с давлением пара, будут перечислены два значения температуры и одно значение давления или два значения давления и одно значение температуры - как только вы это разберетесь, решить это уравнение очень легко.
- Например, предположим, что нам сказали, что у нас есть контейнер, полный жидкости при температуре 295 К, давление паров которой составляет 1 атмосферу (атм). Наш вопрос: каково давление пара при 393 К? У нас есть два значения температуры и одно значение давления, поэтому мы можем найти другие значения давления, используя уравнение Клаузиуса-Клапейрона. Подставляя наши переменные, мы получаем ln (1 / P2) = (ΔHСтим/ R) ((1/393) - (1/295)).
- Обратите внимание, что для уравнения Клаузиуса-Клапейрона вы всегда должны использовать значение температуры Кельвин. Вы можете использовать любое значение давления, если значения для P1 и P2 совпадают.

Шаг 3. Введите ваши константы
Уравнение Клаузиуса-Клапейрона имеет две константы: R и HСтим. R всегда равно 8,314 Дж / (К × моль). Однако HСтим (энтальпия испарения) зависит от вещества, давление пара которого вы ищете. Как отмечалось выше, обычно можно найти значения HСтим для различных веществ в конце учебника химии или физики, или в Интернете (как, например, здесь).
-
В нашем примере предположим, что наша жидкость чистая вода.
Если посмотреть в таблице значения HСтим, находим, что HСтим чистая вода составляет около 40,65 кДж / моль. Поскольку наше значение H выражается в джоулях, а не в килоджоулях, мы можем преобразовать его в 40,650 Дж / моль.
- Подставляя наши константы, мы получаем ln (1 / P2) = (40,650 / 8, 314) ((1/393) - (1/295)).
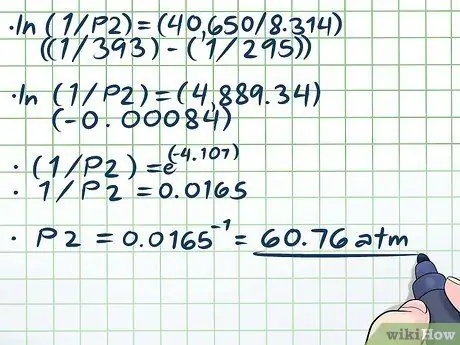
Шаг 4. Решите уравнение
После того, как вы включили в уравнение все переменные, кроме искомой, переходите к решению уравнения в соответствии с правилами обычной алгебры.
-
Единственная сложная часть решения нашего уравнения (ln (1 / P2) = (40,650 / 8, 314) ((1/393) - (1/295))) разрешает натуральный логарифм (ln). Чтобы удалить натуральный логарифм, просто используйте обе части уравнения в качестве показателей математической константы e. Другими словами, ln (x) = 2 → eln (x) = e2 → х = е2.
- Теперь давайте решим наше уравнение:
- ln (1 / P2) = (40,650 / 8, 314) ((1/393) - (1/295))
- ln (1 / P2) = (4889, 34) (- 0, 00084)
- (1 / P2) = е(-4, 107)
- 1 / P2 = 0,0165
-
P2 = 0,0165-1 = 60, 76 атм.
В этом есть смысл - в закрытом контейнере повышение температуры почти до 100 градусов (почти до 20 градусов выше точки кипения) приведет к образованию большого количества пара, что приведет к быстрому увеличению давления.
Метод 2 из 3: определение давления пара с помощью растворенного раствора
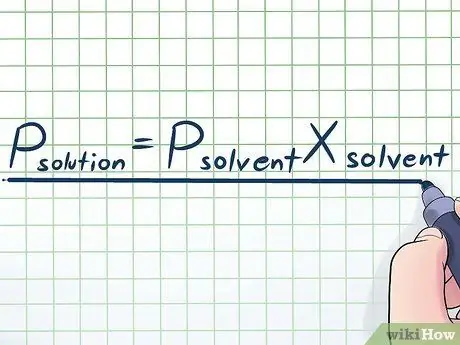
Шаг 1. Запишите закон Рауля
В реальной жизни мы редко работаем с чистой жидкостью - обычно мы работаем с жидкостью, которая представляет собой смесь нескольких различных веществ. Некоторые из наиболее часто используемых смесей получают путем растворения небольшого количества определенного химического вещества, называемого растворенным веществом, во многих химических веществах, называемых растворителем, для приготовления раствора. В этих случаях полезно знать уравнение, называемое законом Рауля (названное в честь физика Франсуа-Мари Рауль), которое записывается так: прастворенный= PрастворительИксрастворитель. В этой формуле переменные представляют;
-
прастворенный:
Давление паров всего раствора (все элементы вместе)
-
прастворитель:
Давление паров растворителя
-
Иксрастворитель:
Молярная доля растворителя
- Не волнуйтесь, если вы не знаете таких терминов, как мольная доля - мы объясним их в следующих нескольких шагах.

Шаг 2. Определите растворитель и растворенное вещество в вашем растворе
Прежде чем вы сможете рассчитать давление паров смешанной жидкости, вы должны определить вещества, которые вы используете. Напоминаем, что раствор образуется, когда растворенное вещество растворяется в растворителе - химическое вещество, которое растворяется, всегда называется растворенным веществом, а химическое вещество, которое заставляет его растворяться, всегда называется растворителем.
- Давайте поработаем на простых примерах из этого раздела, чтобы проиллюстрировать обсуждаемые концепции. В нашем примере, допустим, мы хотим найти давление пара сахарного сиропа. Традиционно сахарный сироп представляет собой водорастворимый сахар (соотношение 1: 1), поэтому мы можем сказать, что сахар - это наше растворенное вещество, а вода - наш растворитель.
- Обратите внимание, что химическая формула сахарозы (столового сахара) - C12ЧАС22О11. Эта химическая формула будет очень важна.
Шаг 3. Найдите температуру раствора
Как мы видели выше в разделе Клаузиуса Клапейрона, температура жидкости влияет на давление пара. Как правило, чем выше температура, тем больше давление пара - по мере повышения температуры больше жидкости испаряется и образует пар, увеличивая давление в емкости.
В нашем примере предположим, что температура сахарного сиропа в этот момент составляет 298 К (около 25 С).
Шаг 4. Найдите давление паров растворителя
Стандартные химические материалы обычно имеют значения давления пара для многих широко используемых веществ и соединений, но эти значения давления обычно действительны только в том случае, если вещество имеет температуру 25 C / 298 K или его точку кипения. Если ваш раствор имеет одну из этих температур, вы можете использовать эталонное значение, но если нет, вам нужно будет найти давление пара при этой температуре.
- Клаузиус-Клапейрон может помочь - используйте эталонное давление пара и 298 K (25 C) для P1 и T1 соответственно.
- В нашем примере температура смеси составляет 25 ° C, поэтому мы можем легко использовать нашу простую справочную таблицу. Мы знаем, что при 25 ° C давление пара воды составляет 23,8 мм рт.

Шаг 5. Найдите мольную долю вашего растворителя
Последнее, что нам нужно сделать, прежде чем мы сможем решить эту проблему, - это найти мольную долю нашего растворителя. Найти мольную долю легко: просто преобразуйте соединения в моль, а затем найдите процентное содержание каждого соединения в общем количестве моль в веществе. Другими словами, мольная доля каждого соединения равна (моль соединения) / (общее число моль в веществе).
-
Предположим, в нашем рецепте сахарного сиропа используется 1 литр (л) воды и 1 литр сахарозы (сахара).
В этом случае мы должны найти количество молей каждого соединения. Для этого мы найдем массу каждого соединения, а затем воспользуемся молярной массой вещества, чтобы преобразовать ее в моли.
- Масса (1 л воды): 1000 грамм (г)
- Масса (1 л сахара-сырца): прибл. 1056,8 г
- Моль (вода): 1000 г × 1 моль / 18,015 г = 55,51 моль
- Моль (сахароза): 1056,7 г × 1 моль / 342,2965 г = 3,08 моль (обратите внимание, что вы можете найти молярную массу сахарозы по ее химической формуле, C12ЧАС22О11.)
- Всего молей: 55,51 + 3,08 = 58,59 моль
- Мольная доля воды: 55, 51/58, 59 = 0, 947
Шаг 6. Готово
Наконец, у нас есть все необходимое для решения уравнения закона Рауля. Эта часть очень проста: просто введите свои значения для переменных в упрощенное уравнение закона Рауля в начале этого раздела (прастворенный = PрастворительИксрастворитель).
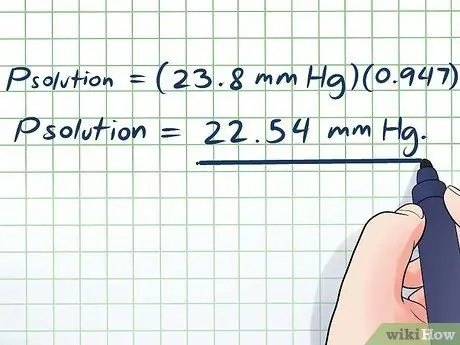
- Вводя наши значения, получаем:
- прешение = (23,8 мм рт. Ст.) (0, 947)
-
прешение = 22,54 мм рт.
Результат имеет смысл - в мольном выражении очень мало сахара растворено в большом количестве воды (хотя в реальных условиях оба ингредиента имеют одинаковый объем), поэтому давление пара снизится лишь незначительно.
Метод 3 из 3: Определение давления пара в особых случаях

Шаг 1. Будьте осторожны со стандартными условиями температуры и давления
Ученые часто используют набор значений температуры и давления как простой в использовании «стандарт». Эти значения называются стандартной температурой и давлением (или STP). Проблемы с давлением пара часто связаны с условиями STP, поэтому важно помнить эти значения. Значения STP определяются как:
- Температура: 273, 15 К / 0 С / 32 F
- Давление: 760 мм рт. / 1 атм / 101, 325 кПа

Шаг 2. Перепишите уравнение Клаузиуса-Клапейрона, чтобы найти другие переменные
В нашем примере в Части 1 мы увидели, что уравнение Клаузиуса - Клапейрона очень полезно для определения давления пара для чистых веществ. Однако не все вопросы заставят вас искать P1 или P2 - многие попросят вас найти значение температуры или иногда даже значение H.Стим. К счастью, в этих случаях для получения правильного ответа достаточно просто перестроить уравнение так, чтобы переменные, которые вы хотите решить, были отделены по одну сторону от знака равенства.
- Например, предположим, что у нас есть неизвестная жидкость с давлением пара 25 торр при 273 K и 150 торр при 325 K, и мы хотим найти энтальпию испарения этой жидкости (ΔHСтим). Решить это можно так:
- ln (P1 / P2) = (ΔHСтим/ R) ((1 / T2) - (1 / T1))
- (ln (P1 / P2)) / ((1 / T2) - (1 / T1)) = (ΔHСтим/Р)
- R × (ln (P1 / P2)) / ((1 / T2) - (1 / T1)) = HСтим Теперь вводим наши значения:
- 8, 314 Дж / (К × моль) × (-1, 79) / (- 0, 00059) = HСтим
- 8, 314 Дж / (К × моль) × 3033, 90 = HСтим = 25 223,83 Дж / моль

Шаг 3. Рассчитайте давление пара растворенного вещества, когда вещество выделяет пар
В приведенном выше примере закона Рауля наше растворенное вещество, сахар, не оказывает никакого давления само по себе при нормальной температуре (подумайте - когда вы в последний раз видели, как миска с сахаром испаряется в верхнем шкафу?). испаряться, это повлияет на давление пара. Мы учитываем это, используя модифицированную версию уравнения закона Рауля: прешение = (PсложныйИкссложный) Символ сигма (Σ) означает, что нам нужно только сложить все давления паров различных соединений, чтобы получить наш ответ.
- Например, предположим, что у нас есть раствор, состоящий из двух химических веществ: бензола и толуола. Общий объем раствора составляет 12 миллилитров (мл); 60 мл бензола и 60 мл толуола. Температура раствора составляет 25 ° C, а давление паров каждого из этих химикатов при 25 ° C составляет 95,1 мм рт. Ст. Для бензола и 28,4 мм рт. Ст. Для толуола. Используя эти значения, найдите давление пара раствора. Мы можем сделать это следующим образом, используя стандартные значения плотности, молярной массы и давления пара для двух наших химических веществ:
- Масса (бензол): 60 мл = 0,060 л и раз 876,50 кг / 1000 л = 0,053 кг = 53 г
- Масса (толуол): 0,060 л и 866 раз, 90 кг / 1000 л = 0,052 кг = 52 г
- Моль (бензол): 53 г × 1 моль / 78, 11 г = 0,679 моль
- Моль (толуол): 52 г × 1 моль / 92, 14 г = 0,564 моль
- Всего молей: 0,679 + 0,564 = 1,243
- Молярная доля (бензол): 0,679 / 1, 243 = 0,546
- Молярная доля (толуол): 0,564 / 1, 243 = 0,454
- Решение: Pрешение = PбензолИксбензол + PтолуолИкстолуол
- прешение = (95,1 мм рт. Ст.) (0, 546) + (28,4 мм рт. Ст.) (0, 454)
- прешение = 51,92 мм рт. Ст. + 12,89 мм рт. Ст. = 64, 81 мм рт.
подсказки
- Чтобы использовать приведенное выше уравнение Клаузиуса Клапейрона, температура должна быть измерена в Кельвинах (записывается как K). Если у вас температура в градусах Цельсия, вы должны преобразовать ее по следующей формуле: Тk = 273 + Тc
- Вышеупомянутые методы можно использовать, потому что энергия точно пропорциональна количеству приложенного тепла. Температура жидкости - единственный фактор окружающей среды, влияющий на давление пара.






